Результаты конкурса "Белка-2024"
 |
Подведены итоги конкурса "Белка-2024". Игра-конкурс по химии "Белка-2024" проводилась 14 ноября 2024 года. Всего в соревновании приняли участие 17 116 учащихся из 1296 учреждений образования Республики Беларусь. |
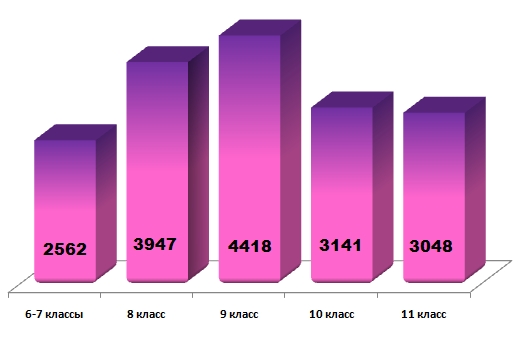
Конкурсные задания были подготовлены для четырёх возрастных групп учащихся: 7, 8, 9-10 и 11 классов. Интерес к игре проявил также и один шестиклассник. Количественный состав участников по возрастному принципу представлен на диаграмме:
На диаграммах ниже приведены данные о том, какой процент правильных ответов получен от участников на каждый из вопросов задания. Уровни сложности вопросов (3 балла, 4 балла и 5 баллов) для наглядности выделены различными цветами. Напомним, что сложность вопросов определяется после проверки всех работ по количеству участников, ответивших на них правильно. 10 наиболее лёгких вопросов, на которые правильно ответило наибольшее количество участников, оцениваются по 3 балла, 10 наиболее трудных вопросов оцениваются по 5 баллов, остальные 10 вопросов оцениваются по 4 балла.
Успешность выполнения задания для 7 класса отражена на следующей диаграмме:
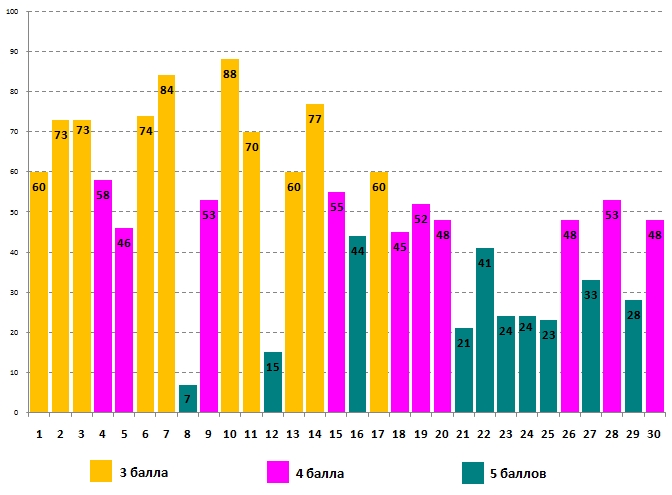
Лучше всего самые юные химики справились с ответом на вопрос №10: 88% участников правильно ответили на вопрос о том, относительная атомная масса какого химического элемента указана неправильно. Наименьшее количество правильных ответов (всего 7%) участники игры дали на вопрос №8. Большинство семиклассников ответили, что исследования Д.И. Менделеева (1834–1907) стали началом современной химии. Дмитрий Иванович Менделеев, без сомнения, был выдающимся учёным, открывшим периодический закон химических элементов. Современная химия начала формироваться как наука гораздо раньше, во многом благодаря работам Роберта Бойля (1627–1691).
Успешность выполнения задания для 8 класса:
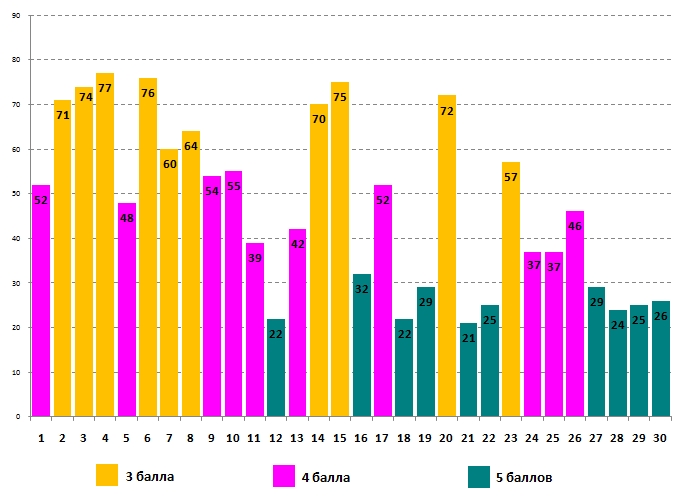
Наибольшее количество правильных ответов (77%) было дано восьмиклассниками на вопрос №4 о том, что к природному газу добавляют одорант, чтобы вовремя заметить утечку газа. Наиболее сложным (21% правильных ответов) для участников стал вопрос №21 об определении объёма газа, выделившегося при реакции разложения твёрдого вещества. Большинство участников выбрали вариант В, посчитав, что нужно обязательно знать формулы всех веществ, участвующих в химической реакции. На самом деле для определения объёма газа (при н.у.) достаточно знать лишь его формулу.
Чтобы ответить на вопрос №21 нужно вспомнить закон сохранения массы веществ, согласно которому, масса продуктов химической реакции равна массе исходных веществ. Согласно условию, нам известна масса исходного вещества и масса твёрдого продукта химической реакции. Соответственно массу газообразного продукта можно вычислить как разность масс исходного вещества и твёрдого продукта реакции. Зная массу газа, можно найти его объём, разделив массу на плотность. Если же плотность газа не известна, массу вещества можно разделить на молярную массу этого вещества (получится химическое количество), а затем умножить на молярный объём, который для всех газов при нормальных условиях равен 22,4 л/моль. Таким образом формулы газа будет достаточно для определения молярной массы либо плотности вещества, а значит, и для решения всей задачи.
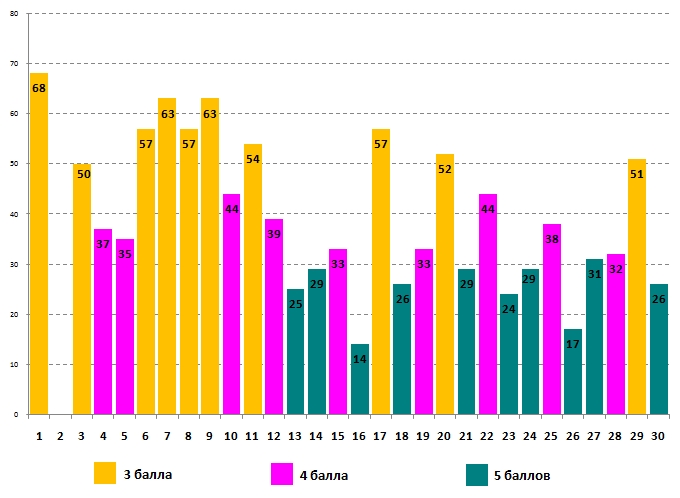
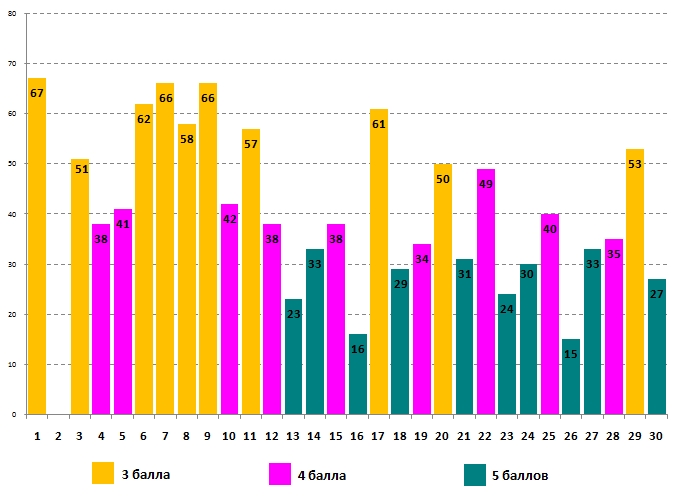
Успешность выполнения задания для 9-10-х классов учащимися 9 класса:
Успешность выполнения задания для 9-10-х классов учащимися 10 класса:
Вопрос №2 этого задания не оценивался из-за несоответствия единиц измерения в условии вопроса и в вариантах ответа.
Все вопросы задания оценены в одинаковое количество баллов для учащихся разных параллелей. Больше всего правильных ответов (68% и 67% соответственно) участники дали на вопрос №1, об изменении цвета сока свёклы, если полить её уксусом. Хуже всего девятиклассники справились с вопросом №16 (14% правильных ответов), а для учащихся десятого класса самым сложным стал вопрос №26 (15% правильных ответов).
В вопросе №16 нужно было выбрать вещество, которое способно испортить свинцово-кислотный аккумулятор. Из названия вида этого аккумулятора следует, что раствор электролита этого аккумулятора имеет кислую среду. Соответственно, нейтрализовать эту среду и тем самым нарушить работу аккумулятора может мел:
CaCO3 + 2H+ = Ca2+ + CO2 + H2O
В вопросе №26 во всех приведённых случаях 1–4 будет присутствовать осадок. Насыщенным называется раствор, в котором содержание растворённого вещества является максимально возможным при данной температуре. Насыщенный раствор находится в химическом равновесии с нерастворённым осадком. Одной из количественных характеристик растворимости соли является произведение растворимости (ПР) равное произведению концентраций образующихся при растворении соли ионов. ПР для каждой соли при определённой температуре – величина постоянная.
ПР(CaSO4) = C(Ca2+) · C(SO42–) – постоянная величина для насыщенного раствора.
При добавлении в раствор твёрдого сульфата кальция (случай 1) он не сможет раствориться, так как при этом увеличились бы концентрации его ионов, а это невозможно. При этом он будет лежать (или плавать) в растворе в виде осадка. При упаривании раствора и последующем его охлаждении до нормальной температуры (случай 2) уменьшается объём растворителя и, чтобы концентрация оставалась прежней, уменьшается количество растворённого вещества. Количество соли "не поместившееся в раствор" при этом выпадает в осадок. Добавленный в раствор твердый кальций (случай 3) вступает в химическую реакцию с водой с образованием гидроксида кальция. При диссоциации гидроксида кальция образуются ионы Ca2+. Так как ПР остаётся неизменным, при увеличении за счёт другого вещества концентрации ионов кальция происходит уменьшение концентрации сульфат-ионов. "Лишние" сульфат-ионы из раствора вместе с частью ионов кальция выпадают в осадок. Таким образом добавление в раствор одноимённых ионов уменьшает растворимость малорастворимой соли. При добавлении в раствор избытка насыщенного раствора фторида калия (случай 4) образуется нерастворимый фторид кальция, который выпадает в осадок.
Успешность выполнения задания для 11 класса:
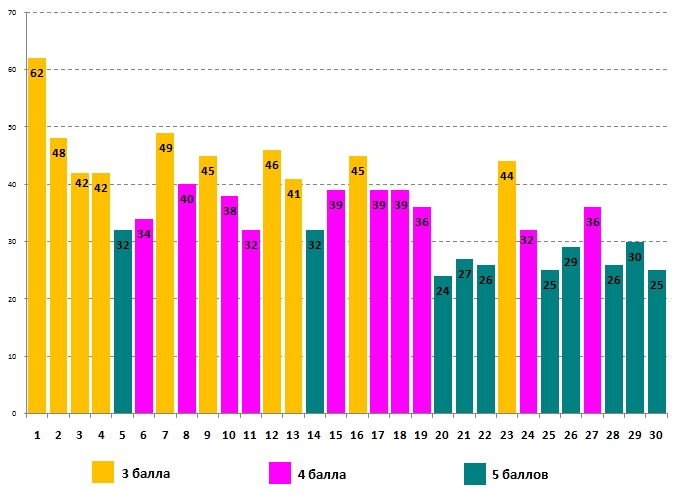
Больше всего правильных ответов (62%) участники дали на вопрос №1 об основных продуктах сгорания дров. Наиболее сложным (24% правильных ответов) для выпускников стал вопрос №20 – задача на определение атомной массы элемента по молекулярным массам его галогенпроизводных. Рассмотрим решение этой задачи.
Зная плотность паров вещества по водороду можно рассчитать его относительную молекулярную массу:
М(фторпроизводного) = 44 · 2 = 88
М(иодпроизводного) = 260 · 2 = 520
Формулы всех галогенпроизводных одного и того же химического элемента имеют одинаковый вид: ЭГn, где Э – химический символ искомого элемента, Г – химический символ галогена, n – количество атомов галогена в молекуле галогенпроизводного. Если бы молекулы галогенпроизводных содержали по 1 атому галогена, то разница в молекулярных массах иодпроизводного и фторпроизводного составила бы A(I) – A(F) = 137 – 19 = 108. Но в нашем случае разница составляет 520 – 88 = 432, то есть в 4 раза больше. Значит в каждой молекуле рассматриваемых галогенпроизводных содержится по 4 атома галогена: 4A(I) – 4A(F) = 432, и формулы их будут иметь вид ЭF4 и ЭI4. Мы знаем, что молекулярная масса ЭF4 равна 88. Рассчитаем атомную массу искомого химического элемента:
M(ЭF4) = A(Э) + 4 · A(F) = A(Э) + 4 · 19 = 88;
A(Э) = 88 – 4 · 19 = 12.
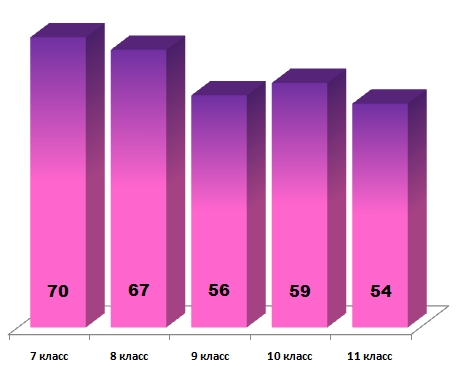
Уровень сложности заданий в целом характеризует средний балл по стране. На следующей диаграмме указан средний балл для каждой параллели:
Обращаем внимание участников и организаторов конкурса, что в течение 15 дней результаты являются предварительными. В это время мы принимаем и рассматриваем ваши обращения и замечания. Через 15 дней после размещения на сайте предварительные результаты конкурса объявляются окончательными и никаким изменениям не подлежат.
Окончательные результаты зарегистрированные на сайте участники смогут добавить в свой личный кабинет.
Каждый участник игры-конкурса «Белка-2024» получит приз «для всех». 20% учащихся, показавших лучшие результаты в своих учреждениях образования, будут поощрены дополнительными призами «за высокий результат».
Благодарим учителей и организаторов за предоставленную учащимся возможность принять участие в игре-конкурсе.
Желаем всем крепкого здоровья, успехов в учёбе и изучении химии.



